ICC 염색 (ImmunoCytoChemistry Staining) 방법은 다음과 같은 3가지 방법으로 수행합니다. 대부분의 실험은 "부착세포에서 세포내 / 핵 단백질을 염색하는 방법 " 입니다 (링크 참조).
그리고, 현탁액에서 고정되지 않은 세포에 표면 단백질 염색방법 (FACS 적용가능) 으로 링크를 클릭하시면 확인하실 수 있습니다. 마지막은 지금 설명드릴 “부착 세포의 표면 단백질의 형광 염색” 방법입니다. 간단하게 소개하고, 세부적인 설명을 추가해서 요약하도록 하겠습니다.
일반적으로 ICC 염색 (ImmunoCytoChemistry Staining)을 수행하는 목적은 세가지 입니다. 첫번째는 타겟 단백질의 세포내 위치 확인하기 위해서, 두번째는 발현시킨 외부유전자의 발현을 확인하기 위해서, 마지막으로 세번째는 2가지 이상의 단백질의 상호간 관련성 (interaction)을 확인 및 검증하는 것입니다. 물론, 한꺼번에 모두 확인할 수도 있습니다.
부착 배양 세포의 표면 단백질 염색
## 실험 수행전 꼭 확인해야 할 사항 ##
1. 어떤 단계에서든 세포가 건조되면 염색(형광)에 심각한 영향을 미쳐 타겟 단백질이 변질거나 위치가 변위되어 세포 표면의 형태가 크게 변할 수 있습니다.
2. 살아있는 세포를 사용할 수 없거나 타겟 단백질이 반드시 고정 후 항원-항체 반응을 해야 하는 상황에서는 3.7% 포름알데히드 (또는 4% Paraformaldehyde in PBS) 에서 상온에서 20분 고정 후 사용합니다. 다른 형태의 고정 (100% MtOH (메탄올), 또는 MtOH : Aceton = 1:1 도 가능) 도 고려합니다.
위와 같을 경우 세포를 먼저 고정(fixation) 후 다음 단계들을 진행합니다.
@ 아래 그림은 "아틀란티스 바이오사이언스 Pte Ltd." 사의 세포염색 (ICC) Kits 를 설명한 홈페이지를 캡쳐한 것입니다. (홍보 아닙니다. 저는 저 제품을 써본적도 없어요! 써볼까.. 싶은 생각은 있네요 ^^)
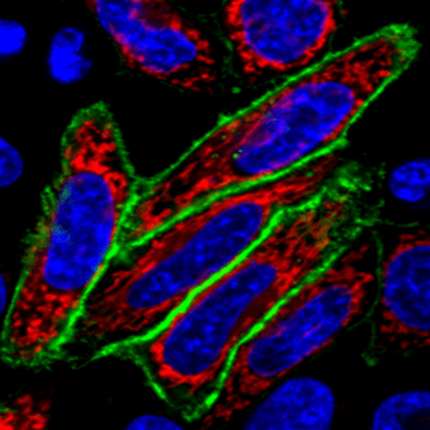
제 실험 결과는 아래처럼 딱~ 이쁜 사진이 없어서 어쩔 수 없이 캡쳐 했습니다.

1. Blocking: 조직 배양 접시에 부착된 배양 세포를 PBS 로 세척한 다음 BSA-PBS 로 구성된 blocking buffer (5% horse serum + 5% goat serum + 5% sheep serum 또는 5% BSA)에서 10 분간 반응시키고 하고 4°C 로 냉각합니다.
(참고: 냉각은 추가된 항체의 세포 내화를 방지하고 세포막(벽) 평면에서 결합 항체의 측면 이동을 최소화합니다.)
2. 1차 Antibody (항체): 살아있는 세포에 1 차 항체를 4℃ 의 PBS 에 넣고 30 분간 반응시킵니다.
(주의사항: 세포에 직접 피펫팅하지 말고 접시 가장자리에 항체 용액을 추가 합니다. 또한, 어떤 단계에서도 세포가 마르지 않도록 항체 용액의 양이 너무 적으면 접시를 앞뒤로 흔들어 세포를 덮을 수 있도록 합니다.)
(참고: 표면 항원 라벨링에 가장 민감한 접근법은 항체가 살아있는 상태에서 세포를 4°C 에서 반응하는 것입니다. 이렇게 하면 내부 라벨링 배경을 방지하고 일부 고정 후 염색에서 나타나는 background 를 최소화할 수 있습니다.)
3. Washing (세척): 1 차 항체 용액을 피펫으로 제거합니다 (Suction 이나 털어버리는 방법은 지양할 것). 4°C 에서 PBS 로 3~5 분간 접시를 다시 세척합니다. (X 3회 이상)
4. 2차 Antibody (항체): 형광 접합 2 차 항체를 PBS 에 넣고 4°C 에서 30~60 분 동안 반응시킵니다.
5. Washing (세척): 2 차 항체를 파이펫으로 제거하고 4°C 에서 PBS 로 3~5 분간 세척 (X 3회 이상)한 후 실온에서 PBS 로 잠시 세척합니다. (Suction 이나 털어버리는 방법은 지양할 것)
6. Fixation (고정): 접시에 부착된 세포를 3.7% 포름알데히드(in PBS) 에 15 분 동안 실온에서 고정합니다.
(참고: 마지막 포름알데히드 고정 단계는 모든 항체 단계를 제자리에 연결하여 해리를 방지합니다. 세포를 즉시 볼 때는 이 단계가 필요하지 않을 수 있지만, 고정 후 장착된 세포는 신호 손실이 거의 없이 4°C 에서 몇 주 동안 보관할 수 있습니다.)
7. Mounting (마운팅): 실온에서 PBS 로 3~5 분간 접시를 세척한 후 변색 방지 및 보관(4°C)용 입니다.
- Counter staining 필요시 DAPI (Final conc. 0.1~1 µg/ml in PBS) 염색 후 PBS or DW washing (X3) 후 mounting 하시기를 추천합니다. (저는 꼭 하는 과정입니다.)
8. 사용한 형광물질(2차 Antibody)에 적합한 필터를 사용하여 형광 현미경 이미지 확인합니다.
※ 2개이상의 단백질 염색은 1차 Ab 의 source 가 다른것으로 (mouse / rabbit 또는 mouse / goat 추천) 사용
2차 Ab 는 각각 green, red 계열을 사용하시면 됩니다.
질문 사항이 있으시면, 아래 댓글(비공개) 남겨 주시면 답변드리겠습니다.
즐거운 실험! 활기찬 실험실 생활 되세요. 홧팅!!!
'전공이야기 > 실험방법' 카테고리의 다른 글
| Plasmid DNA preperation(purification) - 플라스미드 DNA 정제 방법 (manually methods) (0) | 2023.05.02 |
|---|---|
| Cell viability (세포 생존율) 측정 방법 - MTT assay 실험 방법으로 확인 해 봅시다. (0) | 2023.04.26 |
| 쉽게 할 수 있는 ICC staining 실험 - 세포 표면 단백질 염색 방법 (0) | 2023.04.25 |
| 초보 연구자들도 쉽게 할 수 있는 ICC 염색 (ImmunoCytoChemistry Staining) 실험 방법 - 요약 및 정리 (0) | 2023.04.13 |
| PBS buffer (pH 7.0~8.0) 쉽게 만들어 봅시다~^^ (0) | 2023.01.17 |




댓글